
2025-04-29 15:08:51來源:鼎泰集團TriApex瀏覽量:154
作為新型治療藥物,寡核苷酸藥物具有獨特 PK 特征,這是決定其藥理活性和毒理學屬性的物質基礎。本文對這些特征進行系統匯總,并提出了 ADME 研究的思路。
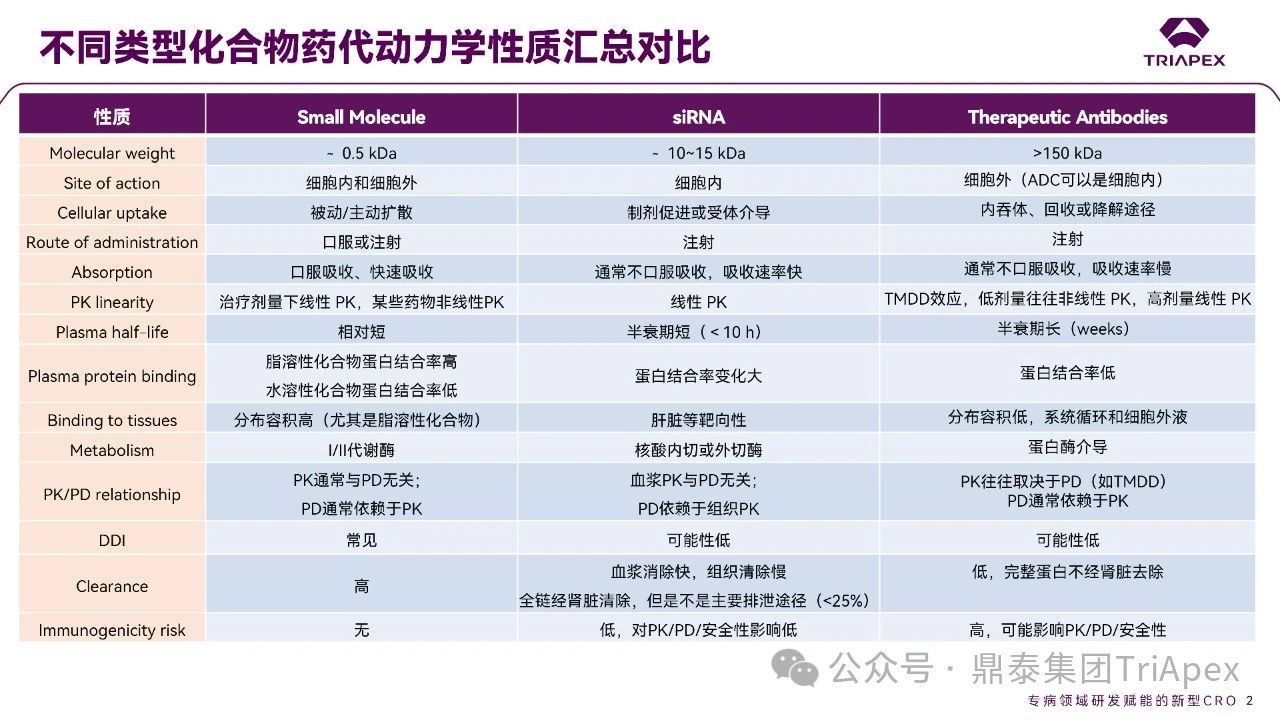
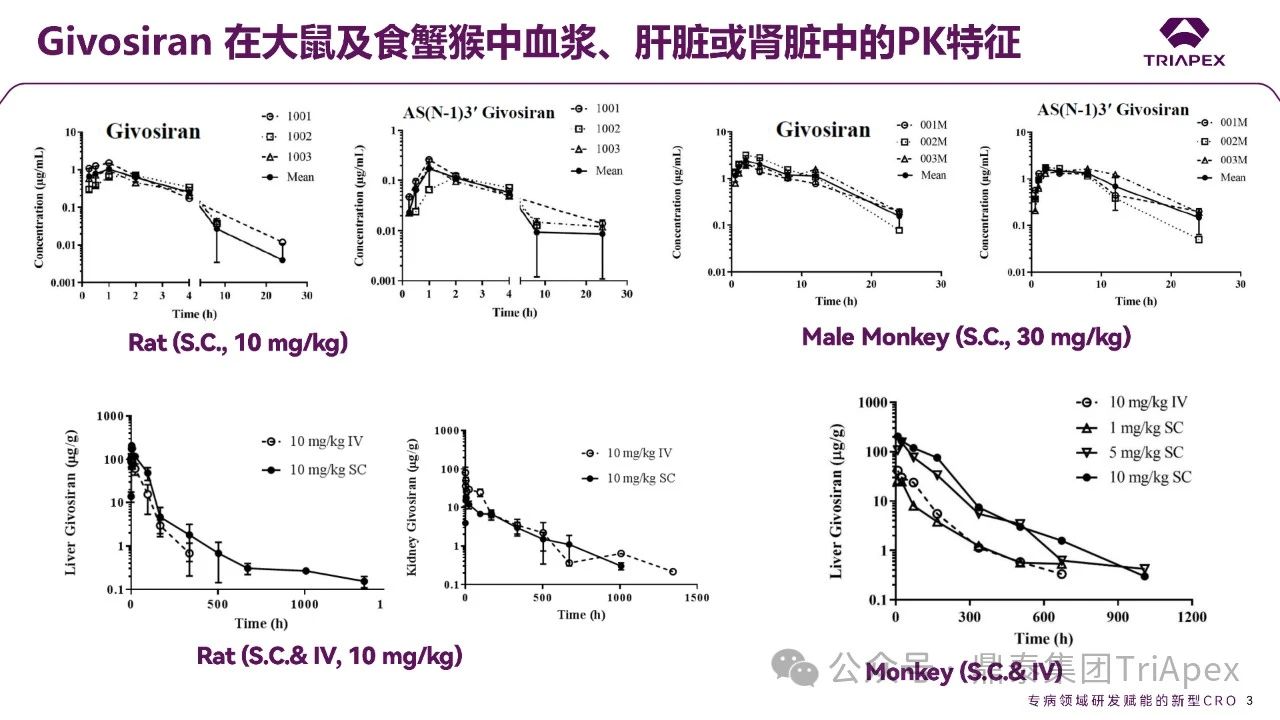
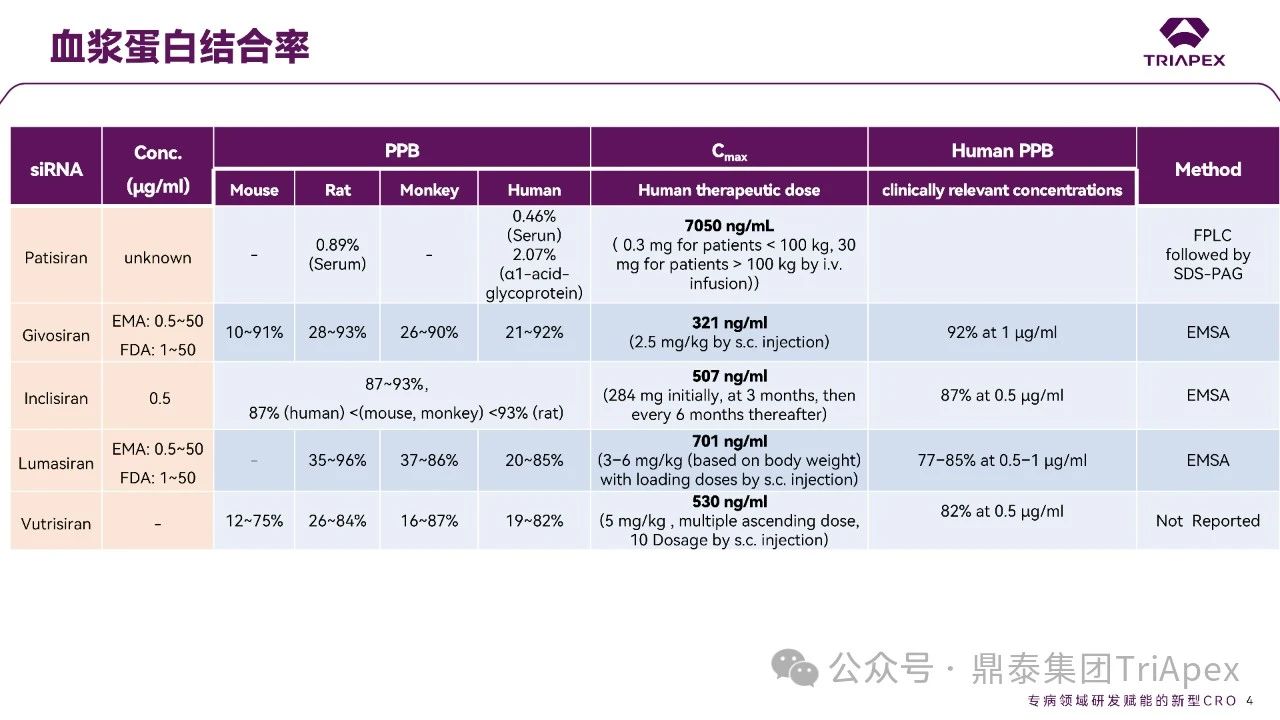
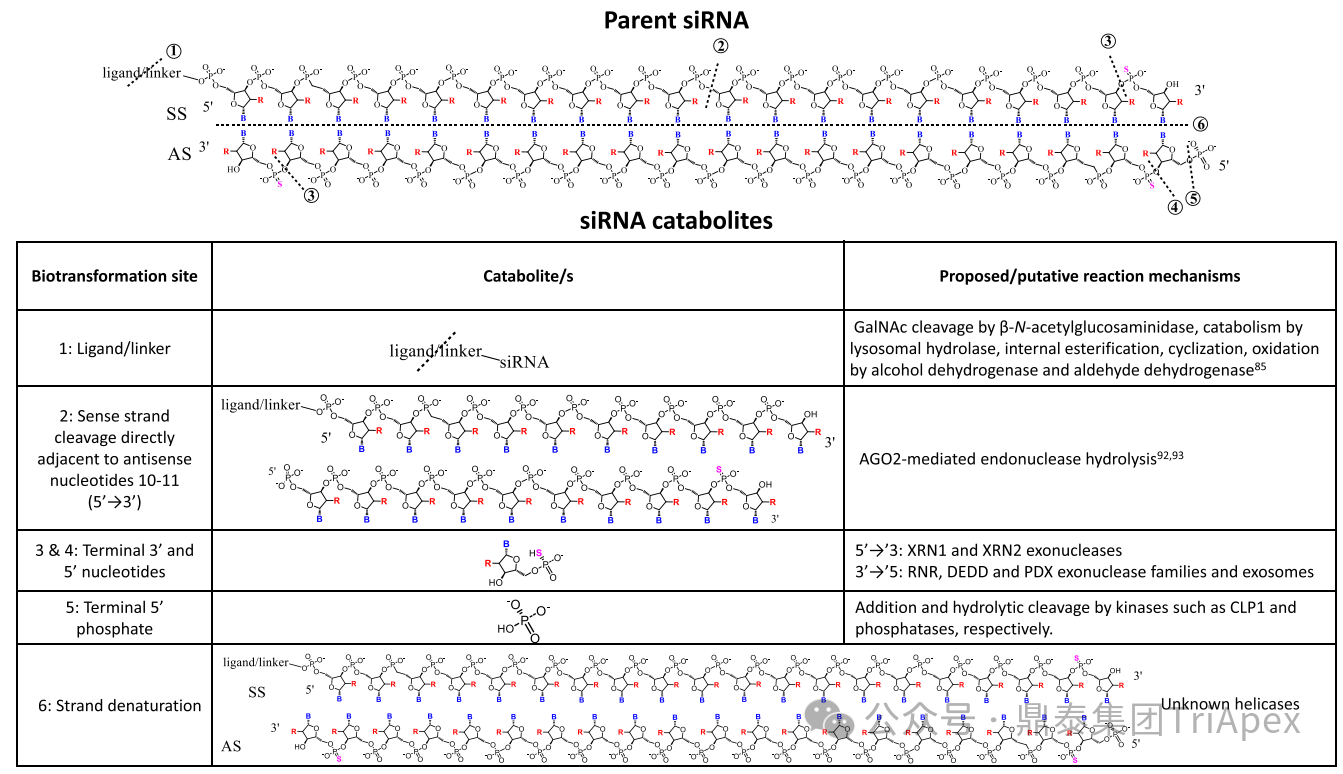
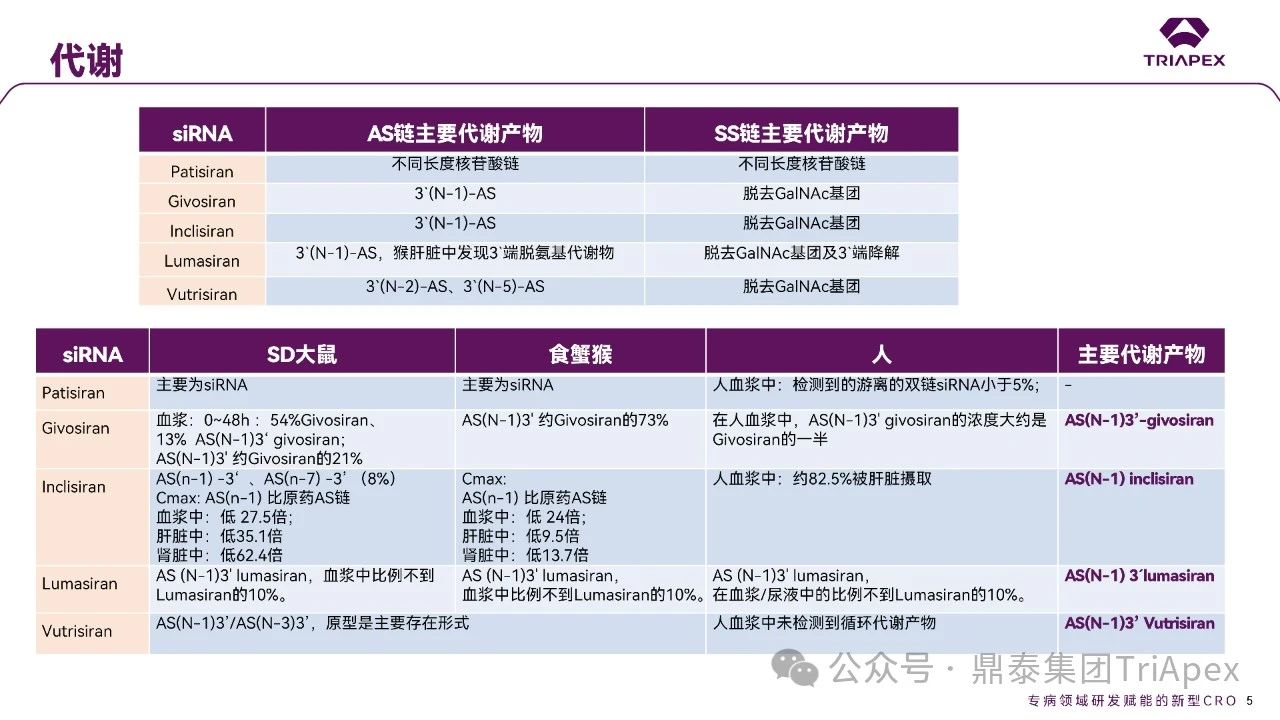
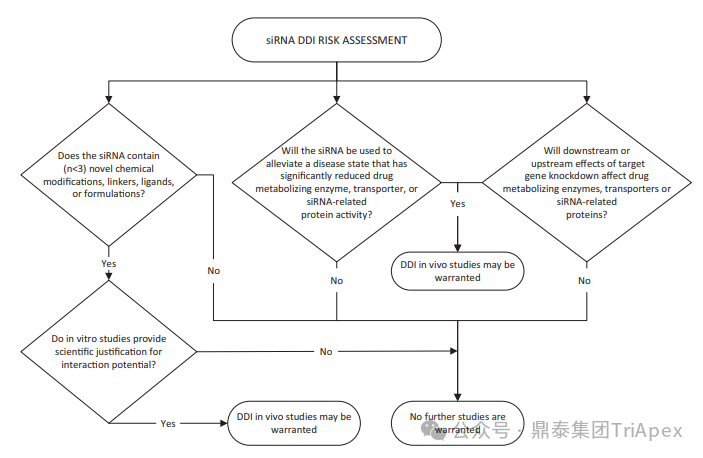
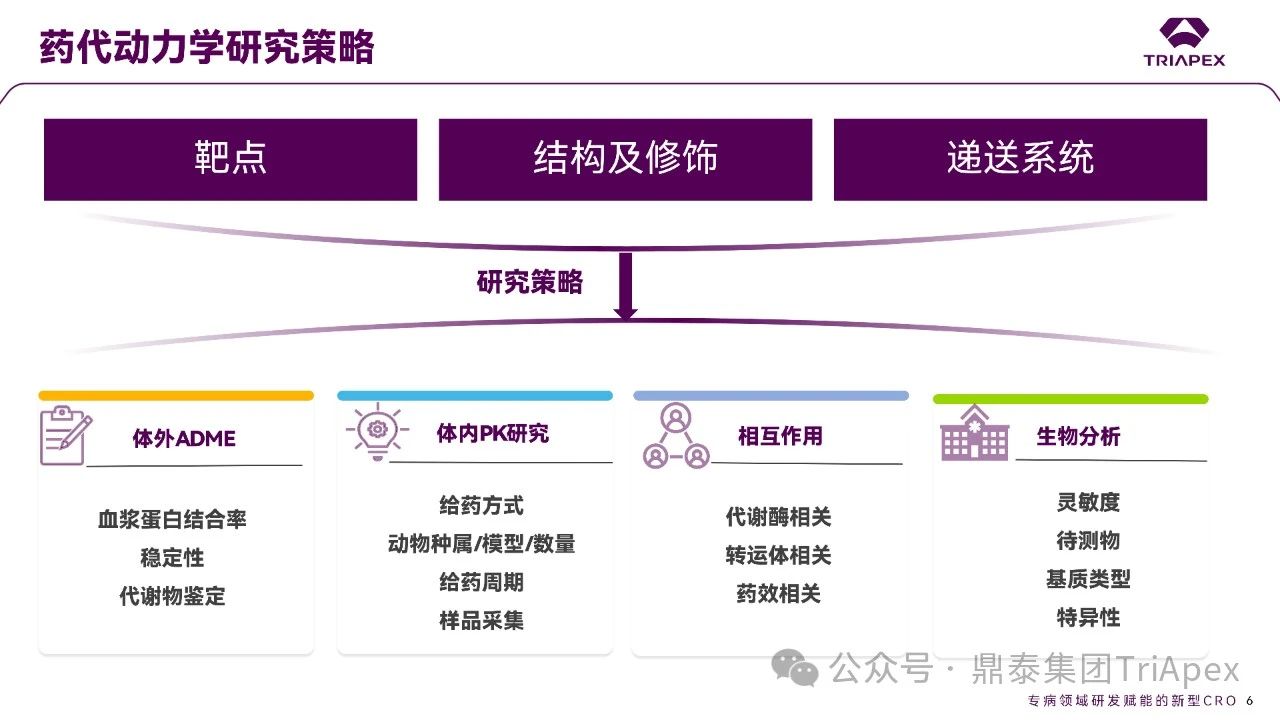
全文共:5643 字 10 圖 預計閱讀時長:15 分鐘 業界已在寡核苷酸藥物的關鍵要素 —— 序列設計、化學修飾和遞送系統等方面積累了豐富的經驗。然而,對于非臨床藥代動力學(PK)研究尚缺乏系統的認識。盡管 OSWG 白皮書中已提供了相關研究思路和建議,但迄今尚無針對寡核苷酸藥物 PK 研究的官方監管指南。目前,針對寡核苷酸藥物的 PK 研究,通常遵循 ICH M3(R2)和 ICH S6(R1)中推薦的研究策略和方法,但由于寡核苷酸類藥物具有獨特的理化性質和作用機制,需根據其特點進行調整與優化研究策略。 在非臨床 ADME(吸收、分布、代謝、排泄及其相互作用)研究中,精準評估寡核苷酸的 PK 特征尤為重要。通過設計精準、結果可靠的 PK 研究,可以更深入地理解寡核苷酸藥物的安全性和有效性,為臨床劑量的推導和給藥方案的設計提供科學依據。如何開展符合科學性和適用性的 PK 研究,是一個凝聚多方智慧和研究策略的過程。本文基于既往經驗和對已批準寡核苷酸藥物 PK 數據的整合分析,提出了系統的非臨床 ADME 評估思路和策略,以期與相關領域的研究者進行交流。 寡核苷酸藥物藥代動力學特征和研究方法 寡核苷酸藥物極性大、水溶性高,不能穿過細胞膜,難以分布至靶器官,易被核酸酶降解,需化學修飾(如硫代磷酸酯)或遞送系統(如 LNP 脂質納米顆粒、GalNAc 偶聯)提高穩定性及改善 PK 特征。總體而言,寡核苷酸藥物呈現出與傳統小分子或抗體藥物不同的 PK 特性(圖2)。 一、吸收 寡核苷酸藥物通常采用的給藥途徑包括:靜脈注射(IV)或皮下(SC)注射等胃腸外途徑全身給藥,或鞘內(IT)或側腦室(ICV)注射、玻璃體內(IVT)注射等局部途徑給藥。 LNPs 包裹的寡核苷酸藥物一般采用 IV 給藥,給藥后從 LNP 中釋放,快速進入血液循環。在一定劑量范圍內,穩態暴露水平(Cmax 和 AUC)與給藥劑量正相關。GalNAc 修飾的寡核苷酸藥物通常采用 SC 給藥,給藥后迅速吸收入血并快速達峰。由于 ASGPR 介導快速分布進入肝臟,寡核苷酸藥物從血漿中快速清除,血漿暴露有限。在一定劑量范圍內,系統暴露水平(Cmax 和 AUC)隨劑量增加而增加;超過一定劑量后,ASGPR 介導攝取暫時飽和,攝取至肝細胞中藥物減少、血漿暴露增加,暴露水平可能會高于劑量增加比例。 一般來說,非臨床 PK 評價中應使用預期的臨床給藥途徑。當臨床途徑不是 IV(如 SC、IT 或 IVT 給藥)時,可能需要開展單次 IV 給藥的 PK 研究,以更全面地表征 PK 特性,確定非靜脈給藥時寡核苷酸藥物的絕對生物利用度。然而,寡核苷藥物生物利用度與藥效(PD)或毒性相關性往往比較差,且絕對生物利用度常因藥物在肝臟中的快速分布而變得復雜,因此基于血漿暴露評估寡核苷酸藥物生物利用度不是一個可靠的方法。監管機構對絕對生物利用度測定的要求并不一致。 寡核苷酸藥物在血漿中 PK 特征不能完全反映靶組織分布、藥效學特征,呈現出血漿 PK 特征和藥效 PD 脫節效應。單次給藥 24~48h 后,血漿濃度很低但藥效持續數十天到數月。此外,血漿動力學和靶組織效應動力學過程在時間上不一致,血漿達峰時間和最大效應時間通常存在滯后性,即短時間血漿暴露在組織中產生長期效應。 圖3. Givosiran 在大鼠及食蟹猴中血漿、肝臟或腎臟中的 PK 特征[3] 二、分布 分布研究的主要目的是確定器官和組織中寡核苷酸藥物絕對和相對(與毒性或活性的靶器官相比)暴露量特征,了解組織 PK/TK 與 PD 和/或毒性關系,在非臨床和臨床方案中指導給藥頻率和/或 PK/PD。 2.1 體外血漿蛋白結合 與小分子藥物作用不同,寡核苷酸與血漿蛋白結合位點為親水性結合位點(小分子藥物:疏水性結合位點),結合親和力本質上基于電荷間相互作用,通常較低且結合短暫。siRNA 與不同種屬的血漿蛋白結合率(PPB)相似,且呈現一定濃度依賴性(圖4)。根據 ICH M3(R2),建議在 IND 申請前或 Ⅰ/Ⅱ 期研究期間獲得 PPB 數據。 PPB 對 LNP 納米顆粒性質、ASPGR 介導的肝細胞攝取、處置、腎臟的清除影響較小。此外,寡核苷酸藥物通過 LNP(如 Patisiran)或 GalNac 介導的途徑攝取進入肝臟,幾乎不受 PPB 影響。攝取進入肝臟后,胞漿中游離藥物濃度取決于內體中藥物穩定性和逃逸效率、肝臟代謝穩定性和胞漿蛋白結合,而非 PPB。因此,無論是 LNP 還是 GalNac 修飾,PPB 數據對于 PK/PD 都沒有明顯影響。文獻報道顯示 siRNA 藥物血漿蛋白結合率高時,可能會短暫延長部分凝血活酶被活化時間和補體激活時間。某些 siRNA 激活補體,可能與 LNP 遞送有關,而非寡核苷酸本身。 2.2 組織分布 目前,寡核苷酸藥物基于肝靶向設計,LNP- 及 GalNAc- 修飾寡核苷酸藥物靶向于肝臟,腎臟、淋巴結等肝外組織水平較低。SC 給予藥理學劑量水平 siRNA 時,與肝臟分布相比,腎臟分布較低(約低 25 倍)。一旦進入體循環,siRNA 藥物迅速攝取進入肝臟,在肝臟中 8~24 小時達峰(Tmax,大鼠:4~8h、猴:8~24h),晚于血漿達峰時間、在肝臟中半衰期比血漿中半衰期長。Lumarisan 在 SD 大鼠及猴肝臟中 Tmax 分別為:6h(血漿:1h)、48h(血漿:2.4h),半衰期(t1/2)分別為 105h(血漿:1h)、409h(血漿:2.6h)。GalNAc- 修飾寡核苷酸藥物藥效與 RISC 復合物中寡核苷酸藥物濃度及在肝臟半衰期直接相關,是在不頻繁給藥情況下實現長效作用的關鍵。 全身給藥(IV 和 SC)時,需進行廣泛組織分布評估,如腎和肝等高攝取組織,特異性靶器官分布也是必要的,通常評估 4~7 個時間點以確定組織半衰期,時間點包括血漿 Tmax、組織 Tmax,理想情況下約為 4~5 個組織半衰期;因此,研究可能會持續相當長的時間,尤其是穩定性高的寡核苷酸。 局部給藥時,應確定與給藥部位相關的組織分布特征(如,IVT:玻璃體液和視網膜層,IT 或 ICV:CSF、腦和脊髓段等)。取樣時間,應仔細考慮緩慢釋放或儲備效應。局部給藥后可能出現長時間全身暴露(盡管可能較低)。 若開展放射性標記組織分布研究,放射性標記的位置應考慮到代謝和潛在短鏈物質。為確保穩定性,通常在寡核苷酸每個分子上標記 1~2 個堿基。雖然放射性標記法評估組織分布比非放射性標記法有一定優勢,但價格更昂貴且時間成本更長。若開展,經典方法是大鼠定量全身放射自顯影(QWBA),但放射性結果不能區分活性原藥(或活性代謝物)和非活性代謝物。 三、代謝 通常情況下,寡核苷酸藥物主要經廣泛分布于血漿和組織的核酸內切酶(Endonucleases)和核酸外切酶(Exonuclease)代謝,水解磷酸酯鍵形成核苷酸片段,而非 Ⅰ 相和 Ⅱ 相代謝酶轉化形成。種屬間核酸酶在結構和功能上較為保守,因此,寡核苷酸藥物在不同種屬間代謝途徑和代謝產物相似(圖5、圖6)。由于不同種屬間代謝的一致性,人體特有的代謝物或在人體中比在動物試驗種屬中存在不成比例的更高水平的代謝物(不成比例的人體代謝物)的可能性遠遠低于小分子。 寡核苷酸藥物代謝研究可通過信息調研、風險評估或體外/體內代謝研究開發數據等。如動物組織代謝物數據可用于靶向結合、亦可測定組織/尿液代謝物,幫助預測潛在人體代謝物。 圖5. siRNA 藥物在體內生物轉化機制[2] 圖6.部分已上市 siRNA 在體內生物代謝 ◆ 體外代謝穩定性研究 通過種屬間比較,確定代謝速率差異,更好地了解可能影響體內代謝的序列和化學修飾。 ◆ 體外代謝物鑒定 由于種屬間代謝途徑一致性,寡核苷酸藥物體外代謝物數據對提供臨床安全性價值較小,因此體外代謝物鑒定不是必須要測定的數據。但是體外研究可提供可能的體內代謝初步評估,通常使用嚙齒動物、非嚙齒動物和人基質開展體外研究。肝細胞提供最接近體內肝細胞特定區域的攝取,但是寡核苷酸藥物如何攝取進入肝細胞是一個亟需解決的問題;相對體內,肝臟 S9 或組織勻漿可能會導致寡核苷酸藥物暴露于不相關區域,過分暴露于核酸酶中。 ◆ 體內代謝 體內代謝研究主要目的是確定代謝物,并確保人血漿中代謝物的安全性,建議至少在長期臨床試驗之前(如 Ⅲ 期臨床)測定體內代謝物。代謝物評估主要基質是血漿和尿液。此外,基質的選擇應基于主要遞送器官或藥效靶組織,如肝臟、腎臟和給藥部位。靶器官中代謝物暴露量更能準確評估組織靶向特異性遞送的寡核苷酸藥物。放射性標記研究通常不用于寡核苷酸的代謝物評估。 ◆ 代謝物安全性測試 盡管發生率可能性很低,FDA MIST 指南適用于寡核苷酸藥物。若比較發現任何特有的或不成比例的人代謝物(即在非臨床安全性評估未定量的代謝物),則應對其進行考慮,以確定是否有必要進一步進行非臨床研究評估其毒性。鑒于寡核苷酸不通過 Ⅰ 相代謝途徑代謝,故幾乎不需要擔心化學反應性代謝物。 四、排泄 開展非臨床排泄研究是為更好指導臨床研究設計,以確定原藥及其代謝物的代謝和消除途徑,有助于決定是否在腎臟和/或肝臟損害患者中開展臨床研究的必要性。寡核苷酸在組織駐留時間較長,在人體中開展放射性標記的質量平衡研究可能不符合倫理。非臨床排泄研究可以用來代替人體質量平衡研究。一般來說,寡核苷酸的排泄途徑往往不那么復雜,大多數寡核苷酸主要通過組織代謝消除,通常只有一小部分作為原形形式排出體外。腎臟排泄程度取決于 PPB 的程度。建議在長期臨床試驗(如 Ⅲ 期臨床)之前確定排泄情況。同時,可基于平臺方法,確認平臺中新化合物排泄研究程度。即,若初步研究證實的結果與使用該平臺的先前化合物獲得結果相似,則不需要對排泄進行深入表征。 五、藥物相互作用 寡核苷酸藥物基于主要 CYP 酶和藥物轉運體、血漿蛋白結合率等直接引起相互作用可能性較小,但需關注藥物作用機制。目前尚缺乏針對特定類型的寡核苷酸藥物總體建議,建議根據作用機制全面評價對聯合藥物的潛在影響,充分評估之間的相互作用。 建議基于平臺方法對寡核苷酸藥物開展 DDI 研究。對于寡核苷酸藥物骨架的化學結構、偶聯物和/或制劑將至少證明一次體外 DDI 可能性。若結果為陽性,則應對該類型的后續寡核苷酸藥物開展體外 DDI 研究。寡核苷酸的代謝產物主要是短鏈產物,DDI 提出應該通過對寡核苷酸藥物評估,對寡核苷酸藥物代謝產物 DDI 的評估通常是不合理的。 基于現有小分子藥物和蛋白質治療藥物 DDI 指南和文獻,以及 FDA/EMA 迄今批準的 siRNA 藥物已公開信息,對 siRNA 藥物 DDI 風險評估建議 DDI 決策樹如圖7所示。將藥物代謝酶、轉運體或其他蛋白質納入 siRNA 的 DDI 評估,考慮 siRNA 和偶聯物的化學結構、賦形劑的化學性質、靶標、疾病狀態和疾病緩解策略,以及靶基因敲除對藥物代謝酶的潛在上游或下游的轉運蛋白或 siRNA 相關蛋白(如 GalNAc-siRNA 和 Ago2 的 ASPGR)。 圖7. siRNA 藥物 DDI 風險評估建議決策樹[4] 5.1 代謝介導的 DDI 寡核苷酸藥物處置不是經肝臟 Ⅰ 相和 Ⅱ 相代謝酶代謝,即不經細胞色素 P450(CYP450)酶代謝。一般而言,寡核苷酸藥物對 CYP 酶不調節或調節作用較小,基本不受 CYP 酶抑制劑或誘導劑影響。Patisiran 對 CYP2B6 有輕度誘導作用,但誘導能力低且 CYP2B6 底物數量有限,在臨床顯示產生相互作用可能性較小。寡核苷酸藥物(不包括遞送部分)由內切酶和外切酶代謝,目前未發現是 CYPs 或 UDP- 葡萄糖醛酸轉移酶等常見藥物代謝酶的底物。因此,體外 DDI 評估寡核苷酸作為藥物代謝酶底物是不必要的。然而,對于偶聯的寡核苷酸及 LNP 包裹型寡核苷酸(含新型成分),底物研究可能是必要的。 5.2 轉運體介導的 DDI 對于寡核苷酸藥物吸收、分布和排泄不太可能在主要轉運蛋白抑制劑產生,無論類型、化學性質、長度、偶聯性等,鮮有證據表明其是參與跨膜運輸的轉運蛋白主要家族的底物。因此,建議至少評估寡核苷酸藥物作為可能參與組織分布和/或清除途徑的特定轉運蛋白的底物研究。 盡管報道有限,與小分子藥物同服時,寡核苷酸藥物偶聯物或制劑成分可能通過非特異性結合競爭轉運蛋白的活性位點,影響轉運蛋白空間位阻。研究表明,雖然 IC50 遠遠大于臨床相關的游離血藥濃度,但某些寡核苷酸確實是藥物轉運體的抑制劑。因此,建議對轉運蛋白組的抑制作用進行評估。此外,對于局部給藥的寡核苷酸藥物,需考慮研究給藥位點有關的轉運蛋白。 5.3 機制和疾病相關 DDI 應考慮基于藥效、間接疾病相關的藥物相互作用,或直接抑制和誘導,如 ASPGR 和 Ago2 等 siRNA 相關蛋白的相互作用。當引起 PD 效應,調節藥物代謝酶(如 CYPs 和轉運蛋白)表達的生化途徑時,基于機制的直接效應是可能的。 FDA 關注寡核苷酸藥物可能以間接方式影響 CYP 活性,如干擾血紅素合成、降解或細胞因子的調節等。建議對 CYPs 和轉運蛋白的潛在影響以及預期臨床適應癥中 CYPs 和/或轉運蛋白表達的調節開展全面文獻調研,并根據需要開展相關研究。 由于寡核苷酸藥物 PD 效應持續時間長,藥物代謝酶表達和/或活性調節的效應都可能被延長。所以,與治療指數低且是 CYPs 或藥物轉運體底物的同服藥物尤其重要。通過了解靶基因敲除的上游和下游效應和/或預測的脫靶沉默效應,對寡核苷酸藥物的基于機制的效應介導的 DDIs 的潛力進行逐一評估。 結語 隨著寡核苷酸藥物研究的深入,藥代動力學的重要性愈發凸顯。全面的 ADME 機制研究對于寡核苷酸藥物的發展是必要的,從靶點設計、結構及修飾、遞送系統等多維度支撐寡核苷酸藥物的藥代動力學研究策略,以全面確保藥物安全性和有效性。 本文主要介紹寡核苷酸藥物藥代動力學一般特征,并對藥代動力學數據進行了總結和分析。致力于通過對寡核苷酸藥物藥代動力學數據分析及法規指導原則學習領悟,由點及面,助力了解寡核苷酸藥物臨床前藥代動力學研究及實驗設計的要點。期望通過本文的探討,為相關領域研究提供一些新的視角與啟示。 目前,鼎泰集團TriApex已建立完善的體內及體外寡核苷酸藥物藥代動力學研究一體化平臺,助力臨床前與臨床轉化研究的深度銜接。遵循 FDA/EMA/NMPA 法規,鼎泰集團可提供全方位的、完備的支持早期發現和分階段支持 IND/NDA 申報所需的藥效學、藥代動力學和毒理學等核心研究。鼎泰集團夯實在藥物開發領域的差異化優勢、關注最新法規政策解讀(點擊查看往期文章)。憑借對藥物的獨特的思考角度和卓越的技術服務能力,正為藥物研發注入強大動能。 供稿:DMPK 部 參考資料:
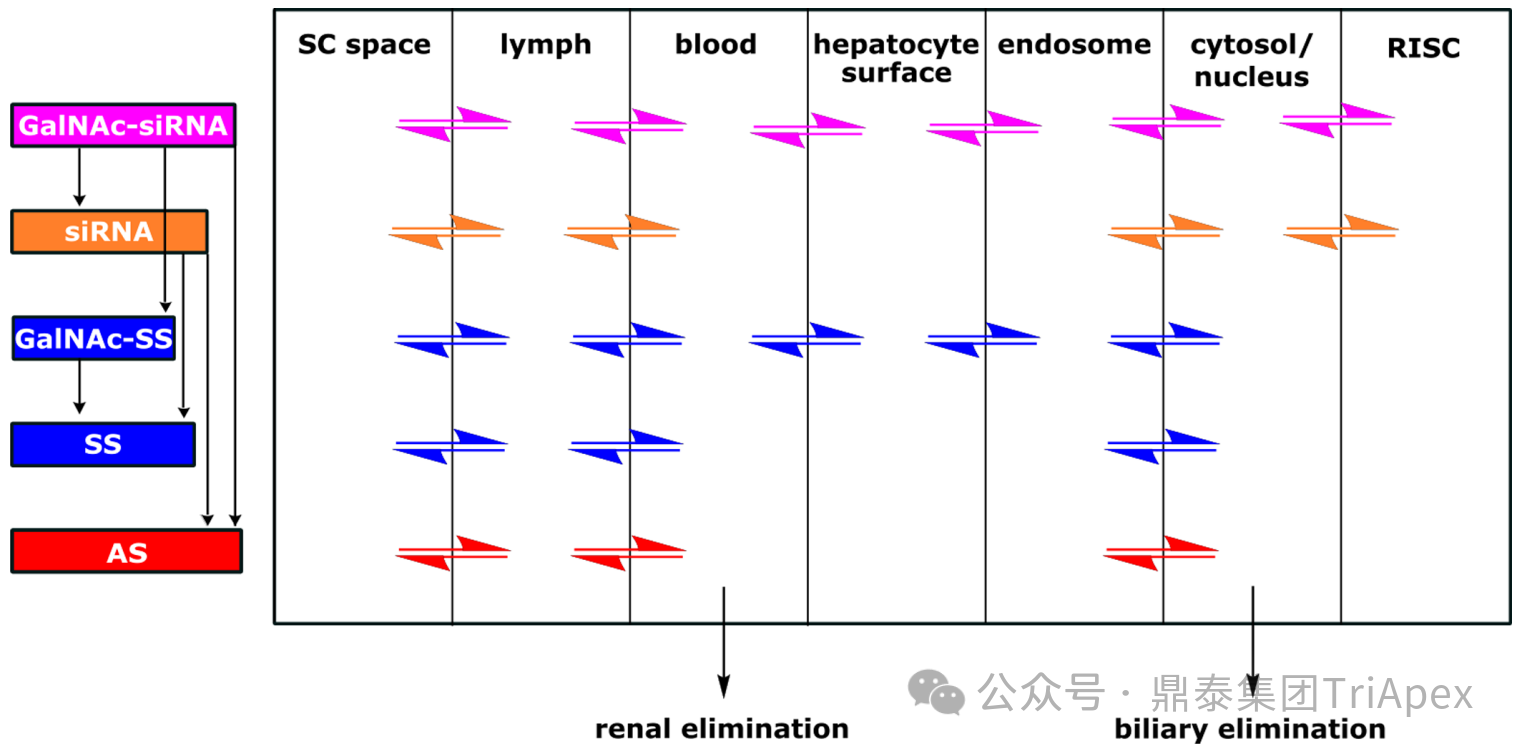 圖1. GalNAc- siRNA 在機體內的 ADME 過程[1,2]
圖1. GalNAc- siRNA 在機體內的 ADME 過程[1,2]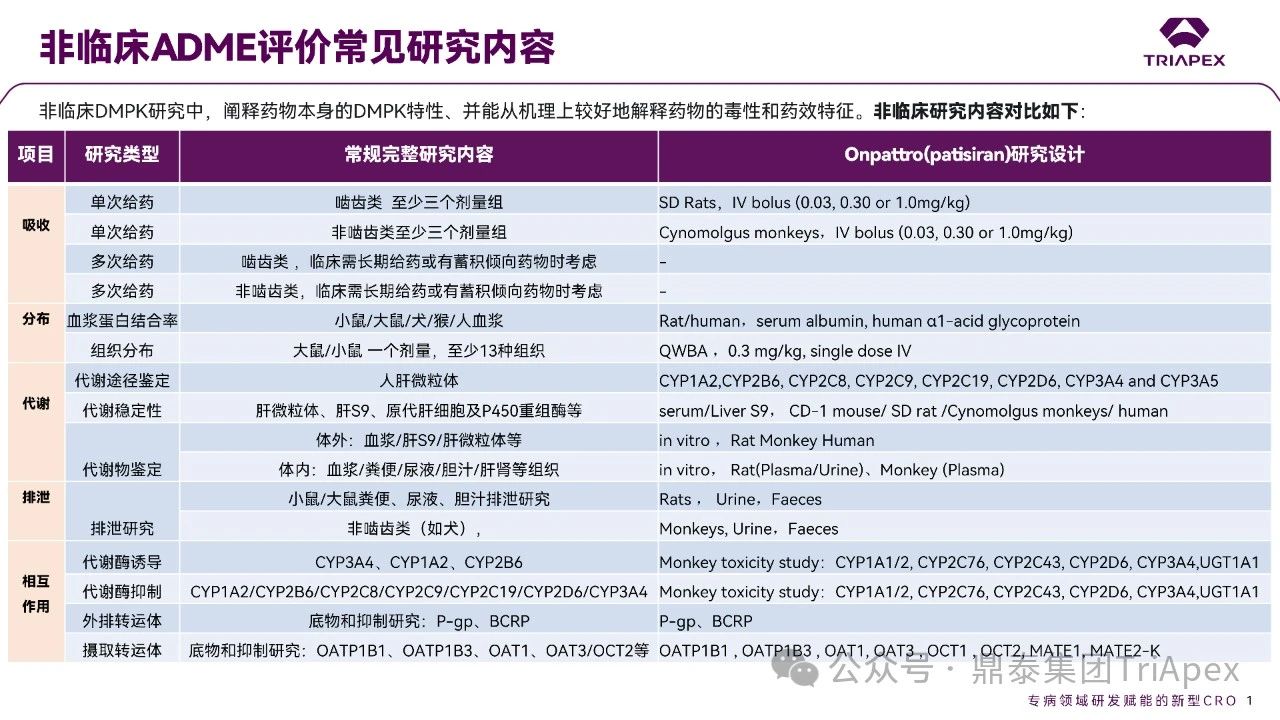
聲明:本文系藥方舟轉載內容,版權歸原作者所有,轉載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內容、版權和其它問題,請與本網站留言聯系,我們將在第一時間刪除內容